填料
如何突破抗体生产瓶颈
单抗类药物由于特异性好,靶向性高,副作用小,疗效显著成为发展最快的一类生物药。
但是中国抗体制药企业也面临巨大的挑战。首先中国药企无论是技术、规模、经验,人才还是资金,跟国际生物制药巨头相比,都有着较大的差距。其次中国加入ich和国际药监督管理体系接轨,降低药品进口关税,对进口抗癌药物实施零关税等系列政策,降低了国外原研药进入中国市场的门槛,给中国生物药公司能够带来了巨大压力和挑战。另外,慢慢的变多的制药企业进入抗体药的开发领域,每个重磅抗体药物大多数都有几十家企业在仿制研发申报,因此国内抗体药企不仅要面临国外原研药巨头的打压,还需要面对国内众多同行及印度廉价药企业激烈的竞争。最后带量采购新政允许通过一致性评价的仿制药与原研药可以一起同台竞标,低价中标,消除了销售经营渠道的壁垒使得国内外生物药企的竞争回归到技术创新,产品质量和成本的竞争。因此国内生物药企是否能在激烈的竞争中取得优势取决于其生产的基本工艺的先进性,因为制药工艺水平决定了产品的质量和成本。
抗体药物生产是个很复杂的过程,大致分为上游的发酵及下游的分离纯化:上游工艺最重要的包含细胞复苏、传代、发酵生产。而下游工艺最重要的包含膜过滤及多步层析分离纯化。过去十多年来,基因工程获得突飞猛进的进步,细胞培养的表达量从原来的不到0.5 g/l 到现在普遍达到5g/l,有些甚至超过10g/l。这些进步是由细胞表达载体的开发,克隆筛选以及细胞培养基优化等技术创新所驱动的。由于发酵产率的大幅度提升,使得上游细胞培养成本大幅度降低(表1)。

与上游十多倍生产效率提升相比,下游分离纯化技术进步明显滞后,导致下游工序成为生产瓶颈,抗体主要生产所带来的成本也转移到下游。
下游工艺在整个生物制药生产中占据60%以上生产所带来的成本,也被认为是最需要改进的技术领域。下游工艺先进性决定了药品的质量,及药品生产效率和成本,也成为生物制药企业的核心竞争力所在。
生物制药下游生产的基本工艺目的是把目标药物分子从复杂发酵液体系中分离出来以满足药品纯度及质量的需求。一方面监管部门对生物药的纯度和质量发展要求慢慢的升高,另一方面生物分子具有结构较为复杂,且对外部条件敏感,稳定性差,杂质多,浓度低等特点,使得生物药分离纯化的挑战更大。比如说治疗用抗体不仅对含量有严格的要求,还必须去除各种潜在的杂质如宿主hcp, dna,endotoxin, 抗体聚集体及降解片段等(表2)。
层析技术具有分离纯化效率高,条件温和且容易保持目标分子的生物活性,因此成为生物制药分离纯化最主要工具。但下游层析分离纯化技术牵涉到材料、生物、化学及设备等交叉技术领域。因此研究下游分离纯化技术的人才较少,另外上游基因工程技术几乎在所有高校都有专业研究团队,而且培养了大量的人才,而下游分离纯化技术却很少在高校有专门研究,也缺乏相关的专业课程来培养分离纯化的人才。过去10多年上游基因工程的迅猛发展虽然带来上游发酵成本的大幅度下降,但下游分离纯化技术进步缓慢使其成本居高不下。因此要降低抗体生产所带来的成本关键就是要解决下游分离纯化的瓶颈问题。
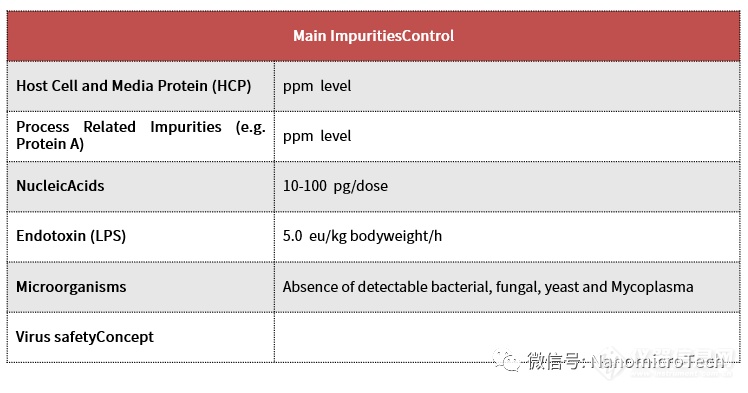
抗体的层析分离步骤基本都能够使用标准化的三步曲:第一步用protein a介质进行抗体捕获和浓缩;第二步用离子交换进行中间纯化以去除多聚体,宿主蛋白等杂质;第三步是精纯去除剩余dna,endotoxin,protein a 等微量杂质。在这三步抗体的分离纯化过程中,第一步的protein a亲和捕获占据分离纯化成本80%以上,也是下游分离纯化的瓶颈所在。亲和层析之所以成本高的根本原因:首先是protein a 价格昂贵,其价格是普通层析介质十几倍;第二,protein a常规使用的寿命短,一般离子交换填料常规使用的寿命多达1000次,而亲和填料寿命通常在100-200次;第三,protein a 用于抗体的捕获和浓缩,需要处理大体积的发酵液,而亲和步骤载量往往又低于阴阳离子交换层析,使得亲和层析介质使用量比中间纯化或精纯的要多得多。因此,要降低抗体的生产所带来的成本,解决抗体的生产瓶颈重点是改进第一步protein a 亲和捕获。

protein a 亲和层析是利用protein a 配基与目标抗体具有专一亲和吸附作用进而达到分离纯化抗体的目的。野生型protein a蛋白是金黄色葡萄球菌细胞壁锚钉蛋白。三维空间上,抗体fc端ch2-ch3区域与protein a蛋白b结构域上两条反相平行的α螺旋结构相互结合。因此protein a与抗体分子特别是与igg1、igg2、igg4有特异性结合,使得抗体分子与发酵液中不具fc端结构的杂质如宿主蛋白与核酸等有效分离,进而达到纯化目的。protein a 亲和层析介质是通过把proteina 配基偶联到微球介质上制备而成的。因为protein a配基与目标抗体的作用的专一性,因此亲和层析的分离纯化工艺和方法与抗体样品杂质含量和种类多少影响不大,使用protein a 介质一步纯化目标抗体就能够达到95%以上纯度,回收率达到90%以上。亲和纯化效率也基本不受杂质多少影响,而其它分离模式如离子交换,疏水,分子筛等的分离工艺方法及效率大多取决于与目的蛋白同时存在的杂质种类和含量。因此,只要样品杂质不同,即使是纯化同样的目标生物分子,采用的分离工艺和方法就不同。以重组胰岛素分离纯化为例,不同厂家虽然生产的是同一目标胰岛素,但采用分离纯化方法完全不一样,根本原因就是每家生产的胰岛素杂
质组成和含量不一样,因此需要不同的纯化工艺。而比胰岛素分子量更大,结构更复杂的抗体基本可以采用标准化的三步曲,主要缘由是protein a 亲和介质的出现大大简化抗体的分离纯化工艺,但protein a 价格昂贵让抗体生产厂家爱恨交加。
protein a 介质价格高的根本原因是其生产工艺复杂,proteina 配基是通过生物发酵生产的,经过纯化后偶联到介质上成为protein a 亲和介质,因此生产成本远高于传统的离子交换、疏水、分子筛等介质。
另一方面protein a产品主要由欧美几家供应商垄断,也是价格居高不下的原因之一。
为了降低抗体生产成本,不少研究工作者在寻找可以取代protein a且价格低廉的新型层析介质来纯化抗体,虽然可能在一些个案中获得成功,但都无法撼动protein a 在整个抗体分离纯化的垄断地位。
因此要降低抗体亲和层析这一步的成本首要的方案是实现protein a 介质的国产化以降低产品价格;
其次是通过采用创新的连续层析工艺技术或其它新工艺以提高protein a 介质的利用率并提高抗体生产效率。
当然不断改进protein a 介质性能使其具有更高的载量和更长的使用寿命也可以降低抗体的生产成本。
目前市场上主流protein a产品是ge生产的以琼脂糖为基质的产品,也是最早商业化的产品。琼脂糖为基质的protein a 介质具有载量高,亲水性能好,非特异性吸附低等优点,但琼脂糖介质天然缺陷是机械强度差,因此也被称为软胶。由于该介质耐压性能差,生产中需要降低柱高、减小流速以防止压力过高造成柱床塌陷,限制了抗体批处理量及抗体生产效率。软胶protein a 另外一个缺陷是传质速度慢,主要原因是软胶孔径较小,排阻大。因此软胶protein a 都需要驻保留时间长,流速慢条件下,抗体吸附载量才会比较高,但在高流速下动态载量下降的非常快。因此一个理想的抗体纯化用protein a 介质需要具有高流速,高载量,高机械强度,及更长的使用寿命等特点。protein a 介质载量是由微球孔径,比表面积,配基密度来决定的;机械强度则是由protein a基球材料化学组成,交联度及孔隙率来决定的;protein a 配基脱落及使用寿命主要由配基,基球性能及偶联方式来决定。实现高性能protein a 亲和介质的国产化需要从底层创新开始。
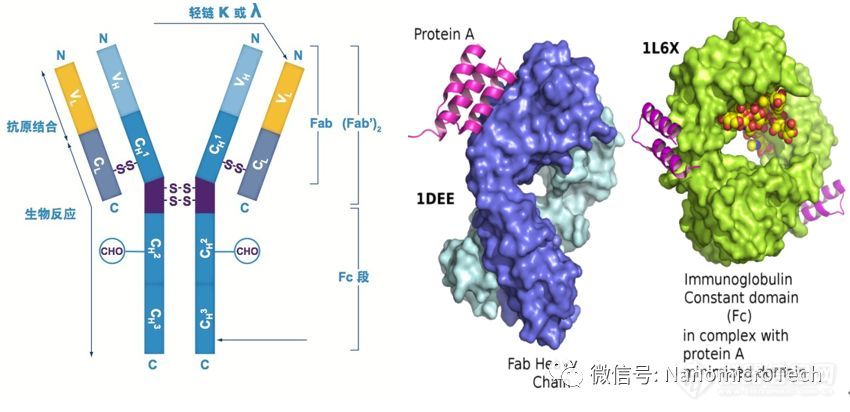
层析介质粒径大小和粒径分布是影响层析分离的重要参数。粒径分布越均匀,装柱越容易、柱床越稳定、柱效越高、流速越均匀、洗脱越集中、分离效率越高、流动相用量越少,柱与柱重复性也越好;protein a 介质被誉为层析介质皇冠上的明珠,价格昂贵,可是市场上protein a 介质都是采用粒径分布较宽的基球。主要原因是单分散微球制备技术难度极大,世界上可以规模生产的单分散多孔微球只有dynal公司一家,ge销售的source 系列单分散聚苯乙烯色谱填料就是dynal生产的。但source 产品的粒径最大只有30微米,不能满足protein a 介质对粒径一般要大于40微米的要求。纳微经过多年的努力开发出世界领先的微球精准制备技术,突破大单分散大粒径多孔微球的制备难题,成为全球第一家生产单分散protein a 亲和层析介质的公司。

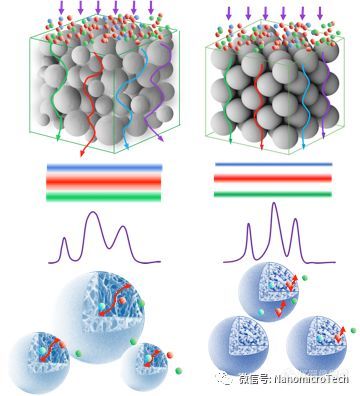
protein a 基球孔径大小会影响生物分子在介质的传质速度和有效载量,孔径越大,分子传质速度越快,在高流速下具有高载量。基于软胶基质的ge protein a亲和介质孔径较小,比表面积高,其静态吸附载量高,但传质阻力大,在驻留时间短,流速快的条件下,动态载量下降的很快。纳微经过优化筛选,专门设计的大孔结构基球,其孔径达到ge protein a 介质的一倍左右。因此该介质传质速度快,使得介质在高流速下具有高载量。从实验测试数据可以看到,纳微unimab与ge mabselectsure在驻留时间大于4分钟时,载量都差不多,当驻留时间小于2分钟时unimab的载量比mabselectsure载量高50%以上, 而且速度越快unimab载量优势越明显。抗体生产效率是由动态载量和流速共同决定,流速越快载量越高,生产效率越高,成本越低,但亲和层析介质的动态载量
与流速成反比,流速越快,载量越低,因此对于每个protein a亲和介质纯化抗体效率都会随着流速升高效率逐步提高,到了一个最优的流速后,如果继续增加流速,纯化效率反而降低。林东强教授实验证明对于批次亲和层析,驻留时间是2分钟时生产效率达到最高,而驻留时间在2分钟条件,unimab的动态载量比mabselectsure 高50%以上。对于连续层析驻留时间是1分钟时生产效率最高,而这个保留时间,unimab的动态载量更是mabselectsure一倍以上。另外从抗体流穿曲线对比图也可以看出具有大孔结构及高度粒径均匀性的单分散protein a亲和层析介质与多分散软胶porteina 介质相比具有更陡的穿透曲线,说明纳微单分散层析介质具有更畅通的孔道结构,分子扩散速度快,抗体流穿少,回收率高。因此利用纳微大孔结构微球不仅可以提高分子传质速度,提高抗体生产效率,降低成本,而且在连续层析中,具有更明显的优势
高机械强度介质不仅可以耐受更高流速、更高压力、更大粘度样品,还可以装更高的柱床,以增加抗体批处理量、提高抗体生产效率、减少设备投资、减少厂房占用面积。
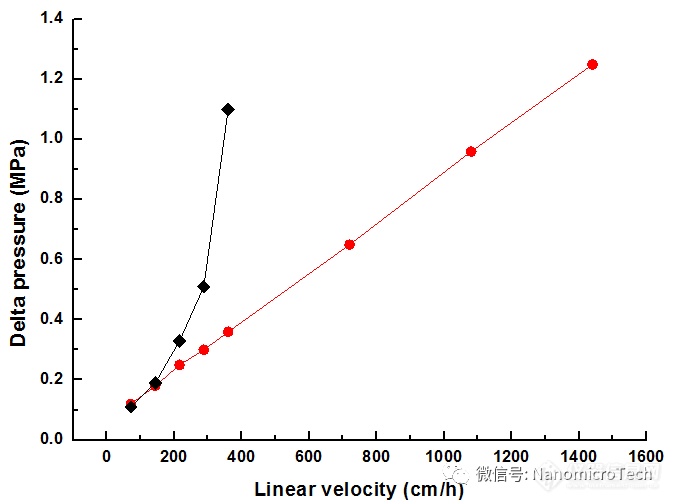
因此纳微protein a 介质是选择高度交联的聚丙烯酸酯基球,与市场上以琼脂糖或低交联度聚丙烯酸酯为基球生产的protein a 介质相比具有溶胀系数小、压缩比例低、而且机械性能强。
实验证明 unimab在2公斤装柱压力下,其柱床压缩比例只有5%,而无论是ge 生产的以琼脂糖为基球还是tosoh 生产的低交联聚合物为基球的protein a 介质压缩比例往往超过15%
用于抗体或蛋白纯化分离的层析介质必须具有很好的表面亲水性,因此市场上主要的protein a 产品要么是基于亲水多糖类材料,或者是用亲水单体做的基球,这种基球虽然亲水性能好,非特异性吸附低但机械强度差。为了保持基球的机械强度并解决介质亲水性问题,纳微采用先合成高机械强度高交联的聚丙烯酸酯微球,然后通过多步表面亲水化改性,再进行protein a配件偶联。这种方法虽然工艺复杂,但生产的介质既有高机械强度,又有表面亲水性能好,非特异性吸附低等特性。因此unimab在抗体分离过程中,hcp去除效果好, 可以达到软胶protein a 的同等水平。

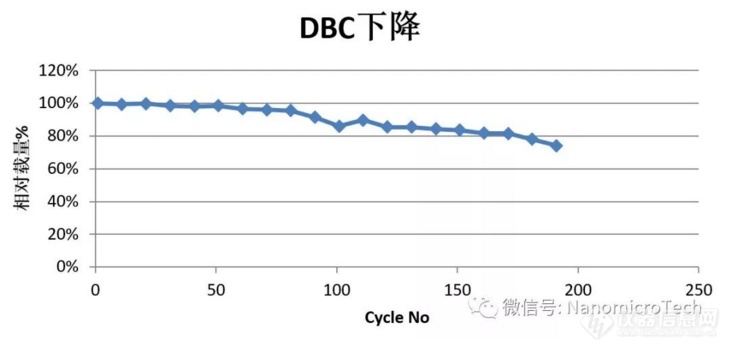
除了基球之外,protein a 配基也是影响介质性能重要因素,尤其是介质的寿命。ge之所以垄断protein a 亲和层析介质市场,最主要的是ge拥有耐碱性protein a 专利技术,其核心专利技术是通过基因工程改变b domain 不耐碱的3个氨基酸以改善其耐碱性能。纳微通过优化组合不同片段设计出新序列的protein a 配基,不仅耐碱性好,而且具有自主知识产权,并能自主实现大规模生产。纳微独有的耐碱性配基加上具有卓越性能的基球,及优化偶联工艺开发出高性能的protein a 亲和介质。以下是某单抗项目上unimab介质载量随使用次数增加的衰减变化表。每个cycle采用0.1m氢氧化钠cip,接触时间1小时。连续200个cycle 后dbc10%依然在初始值的75%左右,充分体现了纳微proteina介质的良好耐碱性。
纳微世界领先的微球精准制造技术,可以对微球的材料组成、粒径大小、粒径均匀性、孔径大小及表面性能达到前所未有的精准控制。
单抗药物的市场竞争越来越激烈,降低抗体生产成本,高效、稳定的产出合格的产品是每个抗体生产厂商追求的目标。亲和层析作为单克隆抗体分离纯化的关键步骤,关系到下游的主要成本及生产效率,产品质量,也是目前下游生产的主要瓶颈。因此纳微通过底层技术创新不仅实现protein a 介质的国产化,而且克服了现有产品的缺陷,必将大幅度提供抗体生产效率,降低抗体生产所带来的成本,更重要的是纳微创新性单分散层析介质可以推动下游工艺技术的创新和进步。比如说高机械强度的protein a 介质就使得通过增加柱床提高批处理量成为可能。而高流速下的高载量及耐高压特性为最终实现抗体连续层析工艺打下基础。
目前ge 生产的protein a 软胶占据抗体分离纯化的90%市场。由于软胶机械强度差,耐压受限(压力小于3公斤),为了防止柱床塌陷,一般柱床只装到15cm高度,严重限制抗体的生产效率,增加抗体的生产所带来的成本。柱床高不仅可以增加抗体的批处理量,提供抗体的生产效率,还可以减少qa及qc等配套人员的工作量,减少纯化系统的数量及设备投资。其实,通过高柱床提高生产效率的方法早在成本更加敏感的胰岛素、白蛋白、多肽等生物药生产上成功实现。但要增加柱床高度,protein a 介质必须具有高机械强度性能,以满足高柱床高流速下产生的压力。纳微开发的新一代单分散protein a 介质是以高交联的单分散聚丙烯酸酯为基质,机械强度高,耐压性能好。因此柱床可以装到40cm以上高度,使得抗体批处理量及生产效率可以提高一倍以上,不仅减少设备投资及厂房的占用面积,而且大幅度降低生产成本。另外实验证明提高柱床还可以提高介质有效载量和利用率,柱床提高一倍,抗体上样量至少增加2.2倍(见表)。高柱床可以解决因为上游发酵规模的扩大及蛋白表达量的增加而带来下游分离纯化生产瓶颈的问题。另外软胶放大往往只能通过等高放大,而纳微生产的高机械强度protein a 可以等保留时间放大。
随着细胞培养技术的迅猛发展,蛋白表达量不断增加以及新兴的连续灌流培养技术的发展对下游纯化效率提出越来越高的要求。批次层析越来越难以满足生产的需求,而连续层析由多根串联的层析柱组成,因为第二根柱子可以承接并吸附从第一根层析柱流穿的抗体,因此第一根柱子可以持续上样到更高的蛋白穿透从而显著提高层析柱的使用载量,进而提高介质利用率,降低生产成本。连续层析可以极大提高设备的利用率,缩短生产周期,还可以减少缓冲液的消耗。
连续层析系统已被认为是下游分离纯化的发展必然趋势,可以大幅度提高抗体下游分离纯化效率,降低生产成本。与批次层析相比,连续层析对设备、软件有更高的要求,而且对介质的要求也不一样。
首先,连续层析由多根串联的层析柱组成。为了保障产品连续生产的质量,对每根柱子的一致性要求高。因此介质填料均匀性就显得更为重要,因为介质越均匀,越容易装柱子,柱效也越高,柱与柱之间的一致性也越好。传统多分散介质由于颗粒有大有小,在装柱过程中大小颗粒的沉降速度不同,使得柱与柱之间差异较大;而且小颗粒容易堵塞筛板,影响流速,大颗粒又会降低柱效,也容易使样品流穿,从而影响分离效率。因此高度粒径均一的单分散层析介质可以克服传统多分散介质在连续生产中存在的问题,单分散介质由于粒径分布均匀可以确保柱与柱的一致性和稳定性。
第二,在连续层析过程中,使用的是串联的小柱子,为了提高生产效率,线性流速要快,这就对层析介质机械强度要求更高,以满足高流速下产生的高压力。目前市场上主流的介质是软胶,耐压性差,只能低流速操作。纳微新型单分散层析介质由于是高度交联的介质,因此机械强度高,可满足高流速的需求。
第三,层析介质的实际有效载量与纯化效率也有直接的关系,实际有效载量是指介质在实际生产条件尤其是流动相速度下的载量。实际有效载量越高,样品上样量可以越大。但线性流速越快,柱保留时间越短,则实际有效载量越低。软胶虽然在低流速下有较高载量,但在高流速下,载量迅速下降。单分散聚合物层析介质是大孔结构的微球,通透性好,蛋白在微球内的传递速度快,因此在高流速下能保持较高的载量。因此粒径均一(单分散),高机械强度,高流速下保持高载量的介质是连续层析生产的理想的介质。连续层析技术是实现连续生产的关键技术。连续生产制药技术是一
种新兴技术,虽然还面临着许多监管的问题和技术的挑战,但连续生产的优越性却显而易见,也是生物制药工艺发展的趋势之一。
随着多个重磅原研生物药的专利到期,为了满足临床市场的需求和降低原研生物药的昂贵医疗费用,越来越多的制药企业进入生物类似药的开发领域,这进一步加剧了生物类似药的竞争,企业成本压力日益凸显。抗体的主要成本在于下游的分离纯化,而protein a 亲和层析成本占据整个层析分离纯化的80%以上,也是下游分离纯化的瓶颈,因此,实现protein a亲和层析介质国产化,并通过底层技术创新改善protein a 机械强度,传质速度及耐碱性能,开发出新一代单分散protein a亲和层析介质,使其可以在高流速下纯化抗体以提高生产效率,减少相关成本生产。另外机械强度高及传质快的protein a 介质又有利于创新连续层析及高柱床的工艺实施,进一步提高抗体的生产效率和降低抗体生产所带来的成本,也为中国生物制药发展实现后发优势提供支撑。
相关资讯
-
2024-05-17
“金”艳全球赛轮拿下国产轮胎历史最好成绩!
-
2024-05-17
【48812】大兴安南湿地环保主题公园十一开园
-
2024-05-17
【48812】我国首个海外高铁项目 雅万高铁最大综合楼成功封顶【组图】
-
2024-05-17
引领中国“新重载时代”——写在浩吉铁路通车之际-新华网
-
2024-05-17
【48812】内蒙古首入全国高铁网 半日即可“通京达海”
-
2024-05-17
【48812】填料塔的核算
-
2024-05-16
迈过安全门槛 阿洛酮糖距新食品原料一步之遥
-
2024-05-16
【48812】色谱填料


